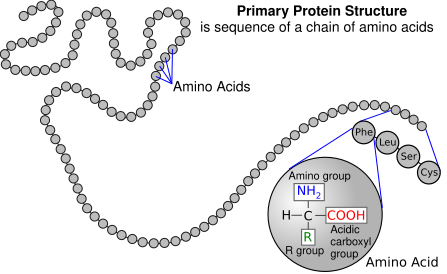
FLUJO DE ENERGIA
Cinética potencial
-luz :
fotones
-E química almacenada en los enlaces
-calor: molécula
-eléctrica : baterías
-electricidad
-E posición “regresa”
-Dependen de la utilidad de la energía,
también que se rige de las leyes la termodinámica
LEYES:
-describe la
propiedades y el comportamiento de la energía en los sistemas
TERMODINÁMICA
Parte química
que estudia las transferencias de calor
En doternamica
:
Introducir
energía para que se pueda dar
Exoternamica :
Libera energía
ENTROPIA
Es la energía
que no puede utilizarse para producir trabajo
Ley 1 : E
universo
Ley 2 :
entropía
Ley 3 :cero
absoluto entropía = O
Universo todo:
S ABIERTO [
materia – energía
S CERRADO [ no
materia – energía
S AISLADO[ no
materia – energía
ENERGIA : capacidad de realizar un trabajo
TRABAJO: w: f. d
*1 principio
de la termodinámica
Calor transferido
a volumen constante
El calor se
mantiene a volúmenes constante
- Calor transferido a presión constante en tapia
Energía libre
de gibbs: propiedad de un sistema
- El sol proporciona el 99 % de la energía de los
seres vivos
- Perdida de la energía:
- Ninguna de la transformación de la energía es
100 % eficiente
- La energía se pierde de forma de luz y de calor
- El carbono puede ser almacenado en las células
Energía de las reacciones químicas
En las reacciones químicas además de una reorganización de átomos se produce un intercambio energético. Los compuestos tienen una energía que denominamos energía química, que es característica para cada uno de ellos, por lo tanto la energía química de los reactivos es diferente a la de los productos.
Cuando la energía de los productos es menor que la de los reactivos se produce una liberación de energía que puede manifestarse de diferentes maneras: calor, luz, electricidad, ..., a este tipo de reacciones las denominamos exotérmicas.
Las reacciones exotérmicas son aquellas que producen calor
Este es el caso de una combustión, cuando quemamos algún material producimos calor y luz. Las reacciones exotérmicas como las combustiones se utilizan en la actualidad para producir la mayor parte de la energía que consumimos (los motores de los automóviles, las centrales térmicas,...)
Si la energía de los productos es mayor que la de los reactivos necesitamos comunicar energía a la reacción para que esta se produzca, a estas reacciones las denominamos endotérmicas.
La reacciones endotérmicas son las que necesitan energía para poder producirse.
Por ejemplo, si queremos descomponer el agua en hidrógeno y oxígeno mediante una electrólisis necesitamos comunicarle cierta cantidad de energía eléctrica.